|
Revisado por Andreas Zabczyk
Diamante y GrafitoDiamante y el grafito son formas cristalinas del elemento carbono. Basado en este hecho, uno pensaría que serían similares en muchos aspectos. Pero en realidad son muy diferentes. Esto destaca algunos hechos importantes sobre los cristales. Tanto el diamante como el grafito tienen una composición química muy simple; ambos son carbono puro. Sin embargo, el diamante es el mineral más duro conocido por el hombre (10 en la escala de Mohs ), y el grafito es uno de los más suaves (menos de 1 en la escala de Mohs). Como resultado, el diamante es el abrasivo definitivo, mientras que el grafito es un excelente lubricante. El diamante es un aislante eléctrico, mientras que el grafito es un buen conductor de electricidad. El diamante suele ser transparente, pero el grafito es opaco. 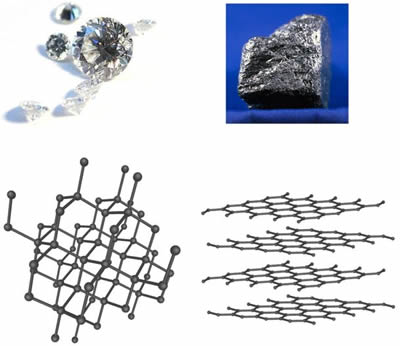 Estructura de diamante y grafito Obviamente, el diamante es mucho más valioso que el grafito. El grafito es tan económico que se usa para fabricar la mina de un lápiz. No obstante, el grafito es un material tan interesante como el diamante en muchos sentidos. El grafito es el componente de alta resistencia de los compuestos que se utilizan para fabricar automóviles, aeronaves, varillas de palos de golf de alta tecnología y raquetas de tenis. Pero, ¿por qué el diamante es tan duro y el grafito tan blando? Además, si el grafito es tan blando, ¿cómo se puede utilizar como material de alta tecnología para ejes de palos de golf y aviones? La respuesta está en las diferentes estructuras atómicas del diamante y el grafito. El grafito se forma en capas u hojas donde los átomos de carbono tienen enlaces fuertes en el mismo plano o capa, pero solo enlaces débiles con la capa superior o inferior. Los átomos de carbono en el diamante, por otro lado, tienen fuertes enlaces en tres dimensiones. En el diamante, los átomos están muy juntos y cada átomo está conectado a otros cuatro átomos de carbono, lo que le da una estructura muy fuerte y rígida en tres dimensiones. En el caso del grafito, solo los enlaces entre las capas de grafito son débiles. Esto significa que cuando las capas o láminas se enrollan en fibras y esas fibras se retuercen en hilos, la verdadera fuerza de las uniones se hace evidente. Los hilos se moldean y se mantienen en su lugar mediante un aglutinante como una resina epoxi. Los compuestos resultantes tienen algunas de las relaciones de resistencia a peso más altas de todos los materiales. Las diferencias entre el diamante y el grafito resaltan la importancia de la estructura cristalina para las propiedades de una piedra preciosa. Por ejemplo, todas las gemas que tienen un hábito de cristal cúbico, donde la estructura del cristal es completamente simétrica, tienen una importante propiedad en común. Los sólidos cúbicos refractan la luz en todas las direcciones a la misma velocidad. Así que a pesar de que el diamante, granate y espinela tienen composiciones químicas muy diferentes, todos son solo refractivo debido a su estructura cristalina similar. Otros grupos cristalinos menos simétricos son doblemente refractivo , incluyendo ortorrómbico, monoclínico y triclínico, todos los cuales tienen ejes y simetrías internas específicas que dictan cómo se curva la luz al entrar en el cristal. |
| STAY IN TOUCH | NEWSLETTER |
| *Se está registrando para recibir correos electrónicos promocionales de GemSelect. |
Derechos de autor © 2005-2024 GemSelect.com todos los derechos reservados.
La reproducción (texto o gráficos) sin el consentimiento expreso por escrito de GemSelect.com (SETT Company Ltd.) está estrictamente prohibida.
14722
