|
|
I tuoi dettagli
|
|
I tuoi dettagli
|
Recensito da Andreas Zabczyk
Diamante e grafiteDiamante e la grafite sono entrambe forme cristalline dell'elemento carbonio. Sulla base di questo fatto, si potrebbe pensare che sarebbero simili in molti modi. Ma in realtà sono molto diversi. Questo mette in evidenza alcuni fatti importanti sui cristalli. Sia il diamante che la grafite hanno una composizione chimica molto semplice; sono entrambi carbonio puro. Eppure il diamante è il minerale più duro conosciuto dall'uomo (10 sul Scala di Moh ), e la grafite è una delle più morbide (meno di 1 sulla scala di Mohs). Di conseguenza, il diamante è l'abrasivo definitivo, mentre la grafite è un lubrificante eccellente. Il diamante è un isolante elettrico mentre la grafite è un buon conduttore di elettricità. Il diamante è solitamente trasparente, ma la grafite è opaca. 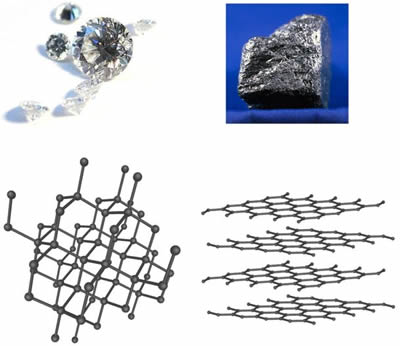 Struttura in diamante e grafite Il diamante è ovviamente molto più prezioso della grafite. La grafite è così economica che viene usata per fare mina. Tuttavia, la grafite è un materiale interessante quanto il diamante in molti modi. La grafite è il componente ad alta resistenza dei compositi utilizzati per costruire automobili, aerei, mazze da golf high-tech e racchette da tennis. Ma perché il diamante è così duro e la grafite così morbida? Inoltre, se la grafite è così morbida, come può essere utilizzata come materiale high-tech per le mazze da golf e gli aerei? La risposta sta nelle diverse strutture atomiche del diamante e della grafite. La grafite si forma in strati o fogli in cui gli atomi di carbonio hanno legami forti sullo stesso piano o strato, ma solo legami deboli con lo strato sopra o sotto. Gli atomi di carbonio nel diamante, invece, hanno legami forti in tre dimensioni. Nel diamante, gli atomi sono molto ravvicinati e ogni atomo è collegato ad altri quattro atomi di carbonio, conferendogli una struttura molto forte e rigida in tre dimensioni. Nel caso della grafite, solo i legami tra gli strati di grafite sono deboli. Ciò significa che quando gli strati o i fogli vengono arrotolati in fibre e quelle fibre vengono attorcigliate in fili, la vera forza dei legami diventa evidente. I fili sono modellati in forma e tenuti in posizione da un legante come una resina epossidica. I compositi risultanti hanno alcuni dei più alti rapporti resistenza-peso di qualsiasi materiale. Le differenze tra diamante e grafite evidenziano l'importanza della struttura cristallina per le proprietà di una pietra preziosa. Ad esempio, tutte le gemme che hanno un abito cristallino cubico, dove la struttura cristallina è completamente simmetrica, hanno un'importante proprietà in comune. I solidi cubici rifrangono la luce in tutte le direzioni alla stessa velocità. Quindi, anche se diamante,granato e spinello hanno composizioni chimiche abbastanza diverse, sono tuttesingolarmente rifrangente a causa della loro struttura cristallina simile. Altri gruppi di cristalli meno simmetrici sono doppiamente rifrangente , tra cui ortorombico, monoclino e triclinico, che hanno tutti simmetrie e assi interni specifici che determinano il modo in cui la luce si piega quando entra nel cristallo. |
