|
|
Seus detalhes
|
|
Seus detalhes
|
Revisados pela Andreas Zabczyk
Diamante e GrafiteDiamante e grafite são ambas formas cristalinas do elemento carbono. Com base nesse fato, alguém poderia pensar que eles seriam semelhantes em muitos aspectos. Mas na verdade eles são muito diferentes. Isso destaca alguns fatos importantes sobre os cristais. Tanto o diamante quanto o grafite têm uma composição química muito simples; ambos são carbono puro. No entanto, o diamante é o mineral mais duro conhecido pelo homem (10 na escala de Mohs ), e o grafite é um dos mais macios (menos de 1 na escala de Mohs). Como resultado, o diamante é o abrasivo definitivo, enquanto o grafite é um excelente lubrificante. O diamante é um isolante elétrico, enquanto o grafite é um bom condutor de eletricidade. O diamante geralmente é transparente, mas o grafite é opaco. 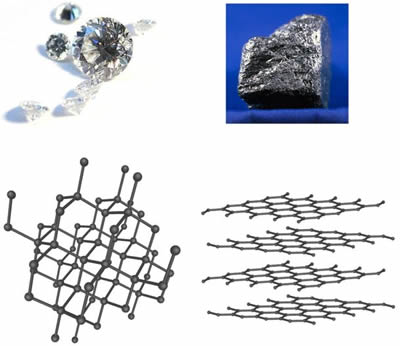 Estrutura de diamante e grafite O diamante é obviamente muito mais valioso do que o grafite. O grafite é tão barato que é usado para fazer lápis. No entanto, o grafite é um material tão interessante quanto o diamante em muitos aspectos. O grafite é o componente de alta resistência dos compósitos usados para construir automóveis, aeronaves, hastes de tacos de golfe de alta tecnologia e raquetes de tênis. Mas por que o diamante é tão duro e o grafite tão macio? Além disso, se o grafite é tão macio, como pode ser usado como material de alta tecnologia para eixos de tacos de golfe e aeronaves? A resposta está nas diferentes estruturas atômicas do diamante e do grafite. O grafite se forma em camadas ou folhas onde os átomos de carbono têm ligações fortes no mesmo plano ou camada, mas apenas ligações fracas com a camada acima ou abaixo. Os átomos de carbono no diamante, por outro lado, têm ligações fortes em três dimensões. No diamante, os átomos estão muito compactados e cada átomo está ligado a outros quatro átomos de carbono, dando-lhe uma estrutura muito forte e rígida em três dimensões. No caso do grafite, apenas as ligações entre as camadas de grafite são fracas. Isso significa que quando as camadas ou folhas são enroladas em fibras, e essas fibras são torcidas em fios, a verdadeira força das ligações se torna aparente. As roscas são moldadas em forma e mantidas no lugar por um aglutinante, como uma resina epóxi. Os compósitos resultantes têm algumas das maiores relações resistência-peso de todos os materiais. As diferenças entre diamante e grafite destacam a importância da estrutura cristalina para as propriedades de uma pedra preciosa. Por exemplo, todas as gemas que possuem hábito cristalino cúbico, onde a estrutura cristalina é totalmente simétrica, possuem uma importante propriedade em comum. Sólidos cúbicos refratam a luz em todas as direções na mesma velocidade. Portanto, embora o diamante, granada e espinélio têm composições químicas bastante diferentes, são todos refração simples devido à sua estrutura cristalina semelhante. Outros grupos cristalinos menos simétricos são duplamente refrativo , incluindo ortorrômbica, monoclínica e triclínica, todas com simetrias e eixos internos específicos que determinam como a luz se curva ao entrar no cristal. |
